再生医療等製品に関する特許期間の延長
平成26 年2 月26日、経済産業省は、再生医療等製品に関する特許期間の延長についてとりまとめたことを発表した。
昨秋の薬事法改正により再生医療関連製品に関する規制が整備され、iPS細胞を利用した細胞シートやヒト細胞に遺伝子導入した医薬品などが新たに「再生医療等製品」とされる(平成26年11月施行予定)ことを受け、特許庁では、再生医療技術のイノベーションを促進する観点から、「再生医療等製品の特許権の存続期間検討WG(座長:熊谷健一 明治大学教授)」において、「再生医療等製品」の特許権について、存続期間延長制度の対象とし、権利保護期間を通常20年のところ、最長25年間とする旨のとりまとめを行った。
当該WGのとりまとめの概要では、「再生医療等製品」に、(使用期限や場所などの条件が付されない)通常の承認制度(改正薬事法23条の25)とは別に、「条件及び期限付承認」(同23条の26)という我が国独自の新承認制度も導入されること(下図参照)に対応して、「再生医療等製品」に関する特許権の延長期間は次のとおりとすることが紹介されている。
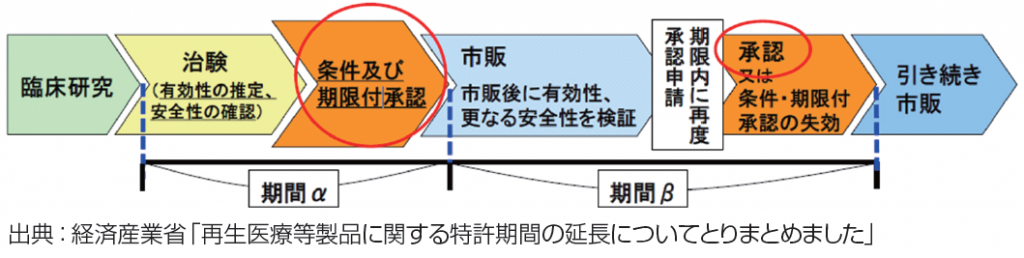
〈通常の承認制度が適用された場合〉 延長期間は、治験開始から承認まで。
〈条件及び期限付き承認の場合〉 延長期間は、治験開始から「条件及び期限付承認」まで。
なお、当該WGの平成26年2月26日議事要旨(http://www.jpo.go.jp/shiryou/toushin/shingikai/saisei-wg02_gijiyousi.htm)によれば、
・改正薬事法施行後の運用をみた上で、「条件及び期限付承認」の「条件」に問題があれば再検討すること
及び
・経過措置について、再生医療等製品の特許権に関しては、施行日以後に延長登録出願されたものを延長対象とすること
が確認されたとのことである。
